들어가기 전에) cytoskeleton 구성하는 세가지(미세섬유, 미세소관, 중간섬유)의 공통점(from Gen bio): maintenance of the cell shape
17.1 Microfilaments and actin structures
ex1) Epithelial cell (apical/basolateral domain-polarized)
ex2) Migrating cell (fibroblast/macrophage) : microfilaments extend.
*Microfilament (미세섬유) --> 액틴, 7-9nm
-microvilli (융털)
-cell cortex (plasma membrane 바로 아래)
-Adherens belt
-filopodia / Lamelliopodium, leading edge
-stress fiber(has focal adhesion/ focal contact
-phagocytosis (내포작용) / moving endocytic vesicles
-contractile ring (cytokinesis, 즉 세포질 분열 진행할 때)
미세 섬유의 역할 예시를 보면 거의 다 세포 안에서 뭔가를 움직일 때 사용된다는 느낌을 받을 수 있다. 내포작용이나 세포질 분열, 세포소기관 이동 등등..
*액틴: 근육세포에는 10%정도, 근육세포 아닌 일반세포에는 1~5%정도 구성하고 있다.
동물의 액틴을 구성하는 단백질 유전서열은 80% 같다. (변이가 많이 안된 만큼 우리 몸에서 중요한 단백질이다)
*G-actin (monomer) -----> F-actin (polymer), helical (2개가 휘감은 구조)
-Each actin molecule contains Mg2+ ion complexed with either ATP or ADP
-1개의 반복 단위는 28 subunit으로 이루어져 있다 (모두 한 방향으로 배열)
(+)말단: favored for the addition. 여기서는 신장, 합성이 잘 일어난다. 그리고 ATP 결합 틈이 옆의 subunit을 향해 있다.
그래서 나중에 미세섬유 있는 구조를 보면 항상 뻗어나오는 쪽이 (+)말단 쪽이다. (융털에서도 튀어나온쪽이 +말단)
(-)말단: 미세섬유의 끝에는 binding cleft가 노출되어있다. 여기서는 길이가 짧아진다. (favored for subunit dissociation)
*미오신이 결합 가능하다! (미세소관, 중간섬유에는 불가능)
17.2 Dynamics of actin filaments
*3 Phases of in vitro G-actin polymerization
i) Nucleation phase → 여기가 속도결정단계 (RDS) 이다
2개나 3개의 G-액틴이 서로 모여서 oligomer을 만든다. 이 oligomer의 길이가 3개가 되면 다음 단계의 'nucleus'로 사용될 수 있다.
ii) Elongation phase (신장단계)
: 짧은 oligomer가 빠른 속도로 양 말단을 신장시켜서 길이가 길어진다.
이때 G-액틴 단량체의 농도가 미세섬유 말단과 단량체 사이에 평형을 이룰만큼 낮아지면 steady state가 된다. (속도 일정해짐) 효소가 기질과 결합하는 그래프에서 나중에 속도 일정해지는 그래프랑 같은 모양이다.
iii) Steady-state phase
: G-actin monomers exchange with subunits at the filament ends, but no net change in length.
특정 농도 이하의 G-actin → 중합 일어나지 않음. (G-액틴의 농도가 중요하다)
→이때의 '특정농도'를 Cc라고 한다. (critical concentration) : filament가 형성되는 농도, steady state에서 단량체의 농도.
(+)말단과 (-)말단이 ATP-G-actin을 소실하는 속도는 비슷하지만 중합하는 속도가 다르다.
(+)에서 실질적인 신장이 일어나지 않는 농도를 Cc+로 표기한다. (이 critical concentration은 당연히 +말단에서 더 중합이 잘 일어나므로 +말단의 Cc가 더 작다.

이렇게 (-)말단으로 갈수록 Actin-ADP, (+)말단으로 갈수록 Actin-ATP 형태가 많아진다. 그 중간은 Actin-ADP-Pi.
이 세개 형태는 뒤에 나오는 단백질 역할을 이해하려면 꼭 알고있어야 한다.
여기서 액틴에 붙는 단백질들을 Actin binding protein이라고 한다.
profilin: ADP-actin에 결합하면 ADP 소실을 증진시킨다 → profilin-ATP-actin complex. 쉽게 말하면 ADP-actin을 ATP-actin으로 바꿔주는 역할을 한다. (신장에 도움)
cofilin: (-)말단쪽의 subunit에만 결합하고, 필라멘트를 절단하는 역할을 한다. (소실에 도움) + 액틴 재활용
profilin과 cofilin이 반대 역할을 하면서 액틴 중합을 조절한다.
*왜 모든 액틴이 중합되지 않을까?
i) thymosin-β4 (actin monomer sequestering system)
→ATP-G-protein에 결합해 액틴 단위체가 말단에 붙지 못하게 한다. (혈소판에 풍부→혈액 응고작용) : 버퍼 같이 작용.
G-액틴 농도가 낮아지면 다시 결합을 해제해서 풀어준다. (평형을 맞추기 위해)
이렇게 해서 액틴의 농도가 높을 때는 모두 중합되지 않게 하고, 액틴의 농도가 낮아서 액틴이 필요할 때는 비축된 액틴을 제공해줄 수 있다.
ii) CapZ : (+)말단에 결합 → 첨가, 소실 억제 (액틴 dynamics를 -말단으로만 제한시킨다) 이름처럼 말단에 capping시켜서 아무것도 못하게 막는다는 거다.
Capping protein인 CapZ는 PIP2에 의해 억제된다.
regulatory proteins function
iii) Tropomodulin : (-) 말단에 결합 → filament 안정화 (트로포미오신에도 결합)
+)
Gelsolin: actin filament 절단 (칼슘이온농도에 의해 조절된다)
actin cross-linking protein
17.3 Mechanisms of Actin filament assembly
*Actin nucleating protein
i) formin : 긴 액틴 필라멘트의 중합 유도 (unbranched filament)
→여기서 unbranched는 stress fiber이나 contractile ring에서 사용된다.
ii) Arp 2/3 complex :branched network 유도 → leading edge에서 사용된다.
Formin : FH2 domain 2개 모여서 이합체 (dimer) → complex → 2개의 액틴 subunit에 결합
→allow insetion of additional subunits between FH2 domain and (+) end. FH2는 (+)말단이 capping되는 것을 막는다.
FH1 domain은 profilin이 결합하는 위치이다 (FH2 부근)
Rho-GDP → Rho-GTP →formin에 결합
(비활성) (활성) (RBD)
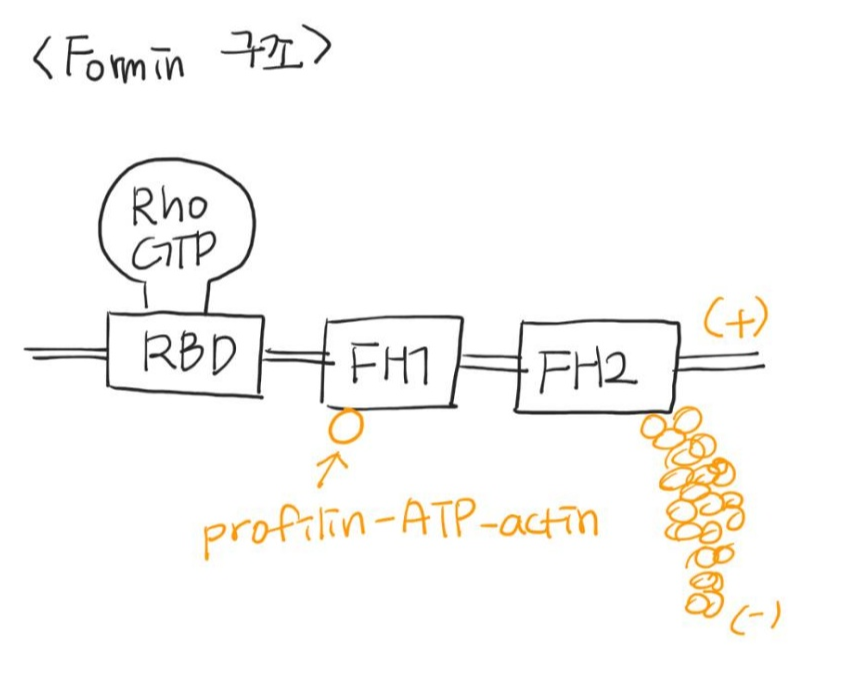
옆에 그림처럼 RBD (Rho binding domain)에 Rho-GTP가 붙으면 중합이 시작된다.
Arp 2/3 complex : branched filament assembly를 시작시킨다.
-NPF (nucleation promoting factor)의 도움으로 활성이 일어난다. (ex: WCA)

1) 액틴이 NPF의 W에 붙고
2) Arp 복합체가 A에 붙는다.
3) 액틴이 Arp 복합체에 결합한다
4) (+)말단의 중합이 시작된다.
+) WASp (NPF의 한 종류) →WCA를 가리는 물질 때문에 불활성 상태
→Wiskott - Aldrich syndrome 환자에게 결핍
증상: eczema(습진), low platelet, 면역결핍
Cdc42-GTP 와 WASp의 RBD 결합 → acidic A domain 노출 (Cdc42는 G단백질의 한 종류)
*Listeria의 움직임 (액틴 polymerization 사용)
-Act A 라는 단백질을 가지고있다. (NPF의 역할을 한다: activates Arp 2/3 complex)
-use 4 proteins (ATP-G-actin, Arp 2/3 complex, CapZ, cofilin)
-polymerization is confined to the back of the bacterium
*VASP
-profilin-ATP-actin과 결합 가능 (ATP-actin assembly 증진)
-새로 형성된 필라멘트의 말단에 붙어있을 수 있다.
-CapZ 막기 가능
*Endocytosis (내포작용): leading edge나 listeria motility와 유사하다.
1) Opsonization(옵소닌화) : surface protein에 대한 특이적 항체에 의해.
2) Leukocyte (백혈구)의 Fc receptor가 Fc영역 인식, signal 보냄 (불변영역을 인식한다)
3) microfilament assembly (with 미오신 motor protein)
4) Phagosome (식포) → 리소좀에 의해 분해
*Toxins
i) Cytochalasin D: F-actin의 (+)말단에 첨가
ii) Latrunculin : G-actin에 결합 (sequesters G-actin)
위의 둘은 미세섬유의 중합을 막는다 (짧아지게)
iii) Jasplakinolide : actin dimer에 결합, nucleation증진
iv) Phalloidin : specifically binds to actin filament, depolymerization 막음. (염색에 쓰임)
이 둘은 미세섬유를 오히려 더 길게 만드는 독소들이다.
17.4 Organization of Actin-based cellular structures
*Cross-linking protein: 액틴 배열, 2개의 F-actin binding site. 두 군데 를 이어주는 단백질이다.

5가지 cross-linking protein들이 모양 다 다르게 생겼다.
*Adaptor protein →액틴 필라멘트와 membrane 연결
Ex 1) Erythrocyte (적혈구)에서 : tropomyosin + tropomodulin (아까 -말단 덮었던 단백질)
i) Ankyrin : spectrin을 bicarbonate transporter에 붙임.
ii) Band 4.1 : spectrin과 F-actin 모두에결합. → glycophorin C에 부착.
→ Spherocytic anemia (빈혈증) : 적혈구가 쉽게 rupture. spectrin, ankyrin, band 4.1에 변이가 생김.
ii) Lateral attachment (측면부착) → ERM protein (Ezrin-radixin-moesin, 이건 몰라도됨.)
인산화에 의해 활성화 된다. cytoplasm에 직접연결되거나 scaffolding protein 사용한다.
→ Muscular dystrophy(영양실조) : 점진적으로 근육이 약화된다. Dystrophin이 없거나 손상된다. (남자에게서 더 흔함)



